Quer emagrecer? Pare de fazer dieta! #EntrevistaDoMês
Índice:
- O que é um loop fechado híbrido?
- Minimed 670G Product Specifics
- Disponibilidade e custo
- 'Um momento da bacia hidrográfica … Transforming Diabetes Care'
- FDA Aprova Libre Pro
- Disclaimer
Uau, que grande momento para a Comunidade Diabetes!
Na quarta-feira, a FDA aprovou o Minimed 670G da Medtronic, o primeiro "sistema de circuito fechado híbrido" que pode monitorar automaticamente a glicose e ajustar as doses basais de insulina em pessoas de 14 anos ou mais com diabetes tipo 1.

Enquanto nós, na Comunidade de Diabetes, percebemos que não é um AP totalmente fechado que assume o controle do diabetes completamente, e a Medtronic em si está tomando cuidado ao se referir a ele como um "híbrido", o novo Minimed 670G representa um enorme avanço na automação do gerenciamento de doenças. Woot!
Aqui está a carta oficial da FDA à Medtronic sobre essa autorização, bem como o comunicado de imprensa da FDA.
Notavelmente, esta aprovação regulamentar chega apenas 104 dias (!) Depois que a Medtronic enviou milhares de páginas de documentos, que é sete meses antes do esperado e esta aprovação apanha mais de uma década de pesquisa, política, e desenvolvimento de produtos para chegar a esse marco.
"Isso é fenomenal, e estou tão animado! "Diz Aaron Kowalski, diretor de missão da JDRF e de longa data do primeiro eleito. "É incrível estar neste nível. Pense nisso - esta é a primeira vez que um desses (sistemas automatizados) foi aprovado … e pouco tempo levou a FDA a limpar isso. "
Então, apenas o que é este novo sistema de controle de glicose e como funciona?
O que é um loop fechado híbrido?
O termo "híbrido" neste caso significa que o sistema é parcialmente automatizado, mas ainda requer algum controle pelo usuário.
A maneira como ele funciona é que o sensor CGM lê dados de glicose a cada cinco minutos e o algoritmo de ciclo fechado incorporado na bomba usa essa informação para aumentar ou diminuir a insulina basal para manter os níveis de glicose o mais próximo possível do alvo de 120 mg / dL. Os usuários ainda precisam inserir contagens de carboidratos e valores em bolus para refeições e alertar o sistema antes de qualquer exercício. Também não dá bolus de correção automática com base em CGM, mas sugere quantidades de correção quando um resultado de dedo é entrou exatamente como todas as bombas de insulina padrão fazem agora através do recurso Bolus Wizard.
< ! --1 ->Esta página da FDA faz um bom trabalho explicando os detalhes. O sistema MiniMed 670G tem dois modos, mais um "piloto automático" do que o outro, mas ambos exigem intervenção do usuário (portanto, não um loop completamente fechado):
Modo Manual - no qual o sistema pode ser programado pela usuário para fornecer insulina basal a uma taxa constante pré-programada.O sistema suspende automaticamente a entrega de insulina se o valor da glicose do sensor cair abaixo ou se prevê que caia abaixo de um limite predeterminado. O sistema também retomará automaticamente a administração de insulina uma vez que os valores de glicose do sensor se elevem acima ou se prevê que aumente acima de um limite predeterminado.
Modo automático - o sistema pode ajustar automaticamente a insulina basal aumentando, diminuindo ou suspendendo continuamente a administração de insulina com base nos valores de CGM (diferente do modo manual onde a insulina basal é entregue a uma constante taxa). Embora o modo automático possa ajustar automaticamente a entrega de insulina basal sem a entrada do usuário, o usuário ainda deve entregar insulina manualmente durante as refeições.
Este é um novo tipo de dispositivo nunca antes visto no mercado - e o fato de aprovado aqui na U. S. primeiro, antes de atingir os mercados europeu e internacional, dificilmente pode ser exagerado.
Minimed 670G Product Specifics
Para o exterior, o Minimed 670G parece e se sente quase idêntico ao recém-aprovado Minimed 630G que traz uma nova orientação vertical e exibição de tela a cores para o design da bomba padrão da Medtronic.

A grande diferença é que esta combinação de bomba de insulina-CGM é controlada por um algoritmo sofisticado que a Medtronic dubs sua "tecnologia SmartGuard Hybrid Closed Loop", que pode fazer esses ajustes automáticos para insulina basal e desligamento automático quando necessário. Os detalhes do produto são os seguintes:
- Unidade de bomba: Conforme observado, o aspecto é o mesmo que o Minimed 630G introduzido apenas no mês passado (já obsoleto?). A mesma bateria do AA, os mesmos conjuntos de infusão e o reservatório de insulina de 300 unidades, e um pouco maior do que as bombas Minimed de estilo tradicional com a orientação horizontal. Em contraste com as bombas Medtronic mais antigas, este dispositivo só está sendo oferecido em preto, mas você pode comprar uma série de diferentes capas para jazz, se desejar.
- Botões e Menus: As únicas pequenas diferenças entre o 630G e o novo MiniMed 670G são o fato de que o botão superior direito o leva diretamente aos gráficos CGM, em relação ao caminho para Menus, eo Menu em si difere um pouco , dado as novas opções de modo, etc., no novo sistema.
- Tela a cores: Como o 630G, o novo sistema também exibe uma tela colorida colorida (!) Que se ajusta automaticamente a situações de iluminação, por exemplo, à noite, ela não acendeu tão brilhantemente quanto poderia durante o dia. Isso parece ser muito mais fácil de ler, um grande benefício para qualquer pessoa com deficiências visuais, é claro. Juntamente com a bomba básica e dados CGM, Insulin on Board (IOB) é exibido diretamente na tela inicial - algo que os usuários clamaram.
- CGM Tech: O novo sistema usa o sensor de CGM de quarta geração em forma de concha da Medtronic, que tinha sido referido como Enlite 3, mas agora será conhecido como o sensor Guardian 3 ( temos um resumo de todos os diferentes termos da Medtronic sobre o Storify ). É liberado pelo FDA para usar no corpo por 7 dias, em comparação com 6 dias para as gerações anteriores.No entanto, não há nada de novo na frente adesiva.

- Precisão aprimorada: O Guardian 3 é mais confiável e preciso, diz a Medtronic, porque usa um novo sinal de rádio (introduzido com o 630G) para se comunicar entre o transmissor e o sensor. De acordo com os dados clínicos de avaliação da empresa em duas calibrações por dia, a taxa de erro MARD é, em média, de 10,5%, o que não é tão bom quanto o mais recente Dexcom G5 a 9%, mas é muito melhor do que o ~ 14% o O Enlite atual tem para oferecer - de modo que é um potente trocador de jogos para tornar a Medtronic um concorrente mais forte no mercado CGM!
- O seu Modo pode variar: A Medtronic diz que ouviu as pessoas sobre querer escolha, por isso está permitindo que ele alterna entre modos: Modo automático para a função de circuito fechado híbrido ou Modo manual que ainda oferece o recurso Suspender em baixo para quando você atravessa esse limiar de hipotensão (como os 530G e 630G ambos) e o Suspend Before Low que pode ser configurado para prever hipos 30 minutos antes de acontecerem (como no 640G disponível internacionalmente).

- Definir BG Target: Esta tecnologia foi projetada para "tratar-para-alvo", o que significa que os níveis de BG são mais próximos do que possível para 120 mg / dL. Infelizmente, isso não pode ser alterado … significando que a Medtronic só leva a "personalização e personalização" até agora. O usuário pode definir um alvo temporário de 150 mg / dL por até 12 horas para lidar com situações como o exercício, mas essa é a única flexibilidade incorporada. A Medtronic diz que isso foi resultado de tentar chegar ao mercado primeiro, porque permitir que alvos diferentes significam ensaios clínicos muito maiores que atrasariam a aprovação e a comercialização da regulamentação. As gerações futuras provavelmente permitirão diferentes níveis de alvo, diz Medtronic.
- Sem compartilhamento de dados: Como o sistema Minimed 630G anterior, este 670G Hybrid Closed Loop não possui Bluetooth integrado e não funcionará com o Minimed Connect para compartilhamento de dados do telefone móvel ( ?!). Para aqueles que querem compartilhamento de dados, a Medtronic está apontando pessoas para seu sistema Minimed 530G que agora tem mais de três anos. Como resultado dessa falta de conectividade, o 670G não funcionará com nenhum dos aplicativos móveis IBM Watson ou compartilhamento de dados em desenvolvimento.
- Medidor BG conectado: O sistema está configurado para se comunicar diretamente com o Bayer Contour Link 2. 4 Metros que a Ascensia introduziu com o anúncio de lançamento 630G. Isso permite o bolus remoto a partir do medidor, mas apenas quando em modo manual em vez de no modo automático de ciclo fechado.
- Duas Calibrações Diariamente: O sistema requer pelo menos uma calibração de dedo a cada 12 horas, e se não for inserido, ele automaticamente chuta o usuário para fora do Modo Automático.
- One-Press Serter: O 670G usa o novo One-Press Serter da Medtronic, que diz que fará a inserção do sensor mais fácil e confortável. Requer apenas uma única pressão de botão, em comparação com a geração anterior que era maior e exigia duas teclas pressionadas (uma vez para inserir e uma vez para se retrair).
- Crianças e adolescentes: Minimed 670G é oficialmente rotulado para 14 anos ou mais, mas a empresa diz que já está realizando ensaios para aprovação em crianças entre 7-13, bem como estudos de viabilidade para jovens de 2 anos. A atual carta de aprovação da FDA indica especificamente que o 670G não deve ser usado em menores de 7 anos, nem naqueles que tomam menos de 8 unidades de insulina por dia (como o dispositivo exige que o mínimo por dia para operar com segurança). A Metronic diz que não tem dados suficientes naqueles que tomam menos de 8 unidades por dia para saber se o algoritmo é eficaz e seguro.
Disponibilidade e custo
Com a aprovação regulamentar muito mais rápida do que o esperado, a Medtronic nos diz que eles precisam de pelo menos seis meses para preparar o lançamento do produto dos EUA a partir da primavera de 2017. Para os que estão fora dos Estados Unidos, a Medtronic diz para esperar aprovação regulamentar em algum momento em meados de 2017.
Há um monte de "partes móveis" que precisam estar no local pré-lançamento aqui na América, eles explicam, além de estarem atualmente no meio do lançamento do Minimed 630G; que o modelo anterior recentemente começou a enviar para pacientes na U. S.
Sim, haverá um caminho de atualização para qualquer pessoa que use produtos atuais da Medtronic - chamado Programa de Acesso Prioritário. É realmente encorajar os clientes a começar no Minimed 630G nos próximos meses antes do 670G chegar ao mercado, anunciando que uma transição como essa ajudará os pacientes a treinar para a nova plataforma e potencialmente reduzir seus custos de bolso para baixo como US $ 0.
- Custo inicial do programa de acesso prioritário = $ 799
- Crédito de troca no sistema MiniMed 630G de bomba e CGM = $ 500
- Custo total do programa de bolso = apenas $ 299
- Participar em pesquisas e outros programas de feedback dos usuários podem também reduz esse custo, até US $ 0 para algumas pessoas, a empresa afirma
O Programa de Acesso Prioritário funciona até 28 de abril de 2017. A Medtronic também diz que mais ofertas e possibilidades de atualização podem ser reveladas mais perto do tempo de lançamento na Primavera.
Claro, a Medtronic também estará trabalhando nos próximos meses com os pagadores e companhias de seguros em cobertura para esta tecnologia. Com toda a controvérsia recente sobre esses problemas (#DiabetesAccessMatters), esperamos que a Medtronic tenha em mente que, embora muitos pacientes desejem este sistema, pode não ser a melhor escolha para todos - e questões de escolha!
'Um momento da bacia hidrográfica … Transforming Diabetes Care'
O JDRF emitiu um comunicado de imprensa na quarta-feira, expressando entusiasmo por esta tecnologia histórica e com a rapidez com que a FDA se mudou. A American Diabetes Association também participou de um comunicado de imprensa sobre essa aprovação, observando seu significado.
Pense nisso: dez anos atrás, muitos ainda pensavam que um sistema de ciclo fechado de qualquer tipo era um pipedream. Mas a JDRF apresentou um plano real em direção ao Pâncreas Artificial. Aquele ainda era os primeiros dias da tecnologia CGM … e veja quão longe chegamos!
"Isso se moveu incrivelmente rápido e mostra quão importante foi o trabalho árduo que fizemos no lado da política no dia, para criar orientação para esses sistemas", disse Kowalski, que pessoalmente desempenhou um papel importante ao tornar o desenvolvimento de tecnologia AP uma prioridade."Isso mudou tudo e criou um caminho, e agora estamos aqui. É enorme, verdadeiramente um momento decisivo que tem o potencial de transformar o cuidado do diabetes!"
Se você considera o Minimed 670G um "Pâncreas Artificial" ou não está quase ao lado do ponto … O fato é que temos um dispositivo agora que está fechando o loop de maneiras que não vimos antes, constituindo uma geração inicial de AP. É uma tecnologia potencialmente em mudança de vida que foi disponibilizada em tempo recorde.

Na verdade, a FDA deu aprovação de mercado para este 670G Minimed, ao mesmo tempo em que exige estudos adicionais pós-mercado visando entender melhor como o dispositivo funciona em configurações do mundo real. Isso mostra que a FDA está disposta a olhar para os dados existentes e confiar nos benefícios, sem reter por resmas de dados futuros.
A viagem é bastante surpreendente, tal como foi capturado nesta publicação pela D-Mom e o defensor JDRF de longa data Moira McCarthy Stanford sobre como a organização abriu o caminho para este marco e além.
Também falamos com Jeffrey Brewer, que lidera o Bigfoot Biomedical, que está desenvolvendo seu próprio sistema em circuito fechado, que deverá estar disponível em algum momento em 2018. Além de Aaron Kowalski, Brewer é considerado um dos "Pais do AP" Dado seu papel em ajudar a desenvolver e promover a via de circuito fechado na JDRF.
"Estamos entusiasmados com o fato de a FDA se mover mais rápido e é mais solidária com os sistemas automatizados de entrega de insulina e nós buscamos ser auxiliados pelos mesmos ventos!" Brewer nos disse.
Sem dúvida, isso irá mover a agulha para a frente nos mais de 18 outros sistemas de circuito fechado nas obras - especialmente aqueles que usam apenas insulina. Alguns adicionam hormônio glucagon adicional à mistura para combater a hipoglicemia (como Beta Bionics iLET e Pancreum Genesis), o que pode exigir mais tempo de avaliação do FDA.
Estamos felizes em ouvir nossos amigos na comunidade do-it-yourself em #OpenAPS também estão entusiasmados com esta nova aprovação e o que isso significa para todos nós.
É ótimo ver a FDA se mudar tão rapidamente, não apenas nesta aprovação Minimed 670G, mas com outros desenvolvimentos de tecnologia e dados de diabetes interessantes nos últimos anos. Claramente, o FDA está reconhecendo o movimento #WeAreNotWaiting, e fazendo o melhor para acompanhar esses tempos de rápido movimento.
FDA Aprova Libre Pro
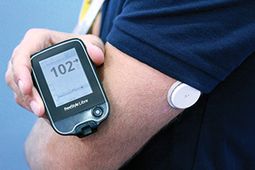
Este não é um dispositivo de consumo, mas a versão clínica de Abbott's nova tecnologia Flash Glucose Monitoring (FGM) que já está disponível para pacientes no exterior.
Também referido como um sistema "híbrido" - mas apenas para o monitoramento da glicemia - o Abbott Libre consiste em um pequeno sensor redondo usado por até 14 dias na parte de trás do braço e um controlador que os usuários simplesmente deslize sobre ele quantas vezes por dia, conforme necessário ou desejado, para obter leituras de glicose sem fio.
Não oferece alarmes para aumentar ou diminuir os níveis de glicose, e a versão do consumidor no exterior armazena apenas 8 horas de dados.O objetivo é criar uma solução de monitoramento mais simples que também possa ajudar muitos tipos 2 a estarem mais em contato com seus níveis de glicose em tempo real.
Embora não seja um CGM tradicional como o conhecemos, Abbott diz que as regras reguladoras classificam o Libre como um CGM. E o que aprovaram agora é uma versão especificamente destinada aos médicos para emprestar aos seus pacientes para uso a curto prazo e apenas fornece dados cegos para os médicos serem vistos. É um primeiro passo para a versão do consumidor, que Abbott também recentemente solicitou a aprovação da FDA aqui nos Estados Unidos.
Espero que isso venha em breve, com a rápida e rapidamente escalada inovação da FDA.
Um grande agradecimento a todos os envolvidos - e não aos da FDA - por ter movido essas importantes ferramentas de cuidados com diabetes em todos os nossos melhores interesses!
Disclaimer : Conteúdo criado pela equipe da Diabetes Mine. Para mais detalhes clique aqui.Disclaimer
Este conteúdo é criado para Diabetes Mine, um blog de saúde do consumidor focado na comunidade de diabetes. O conteúdo não é revisado por médicos e não adere às diretrizes editoriais da Healthline. Para mais informações sobre a parceria da Healthline com Diabetes Mine, clique aqui.
Sobre ser um empreendedor de diabetes focado em Loop fechado

D-Mãe e médica Jennifer Schneider no desenvolvimento de uma nova bomba de insulina e sistema de circuito fechado para diabetes com o Controle Automático de Glicose no Modo de Inicialização (ACG).
Teste-Testando o sistema de loop fechado Diabetes Medtronic 670G

Um homem de Minnesota é uma das apenas 15 pessoas que fazem parte de um estudo atual sobre o Minimed 670G, precursor de um sistema de pâncreas artificial.
Fechado-Loop Progress Report



