Quer emagrecer? Pare de fazer dieta! #EntrevistaDoMês
No mundo dos dispositivos de diabetes, executivos da empresa , PR profissionais, representantes de vendas e até mesmo médicos são muitas vezes vagos sobre quando novos produtos irão chegar ao mercado e estarão disponíveis para nós, pessoas com diabetes. Eles abordam novas ferramentas "em breve" sem qualquer especificidade quanto ao momento em que um produto pode estar disponível. E em fóruns de mensagens freqüentados por pacientes, os rumores podem voar.

Após um ano emocionante de novas aprovações de produtos de diabetes em 2012, queríamos saber mais sobre o status desses desenvolvimentos e onde os fornecedores estão em condições de obter esses novos produtos D em nossas mãos .
Todos nós sabemos que, às vezes, olhar para as introduções de dispositivos de diabetes no exterior é meio como peering em uma bola de cristal para o que está acontecendo Stateside, mas ainda é difícil adivinhar uma linha de tempo específica para a aparência na U. S.
O companheiro D-Blogger Michael Aviad em ASweetLife compilou recentemente uma lista de sete novos produtos D esperados em algum momento deste ano. Com o relógio marcado agora que 2013 começou, achamos que vale a pena olhar para exatamente quando alguns desses e outros novos produtos são realisticamente esperados para atingir o mercado.
Então, aqui está o nosso check-up de realidade atualizado sobre o que esperar em 2013 (ou pelo menos "palavra" dos próprios fornecedores):
Abbott FreeStyle Navigator II
Lembre-se do sistema FreeStyle Navigator CGM (monitoramento contínuo de glicose contínuo) que foi descontinuado nos EUA pela Abbott em agosto de 2011 (depois de sermos liderados por um Muito tempo que foi "suspenso" um pouco)? Bem, nós obtivemos uma palavra na sequência da conferência EASD (Associação Europeia para o Estudo do Diabetes), em outubro, que a Abbott estava explorando um silencioso lançamento de seu navegador de próxima geração para os EUA. Na época, o diretor de assuntos públicos da empresa não nos disse nenhuma apresentação formal foi feito na EASD, e que nada estava ocorrendo em relação a um lançamento nos EUA.
Mas ficamos curiosos. Especialmente depois de aprender sobre um ensaio clínico aprovado pela FDA aqui em Santa Fe, NM e Atlanta, GA, envolvendo o Navigator II. E depois de ver imagens e detalhes aparecerem online no site alemão da empresa.

Nós chegamos ao início deste novo ano para o diretor de Relações Públicas, Jeff Christensen, e ele nos disse:
"Como você está ciente, o sistema FreeStyle Navigator original foi descontinuado nos EUA. Esse status continua inalterado. para o FreeStyle Navigator II, normalmente não divulgamos uma estratégia comercial específica ou nossos planos para limitações regulatórias. No entanto, posso confirmar que continuamos a desenvolver nossa próxima geração de produtos com base na tecnologia de detecção no coração do FreeStyle Navigator … < "O estudo específico ao qual você se referiu envolveu 31 inscritos e foi completado, conforme observado na entrada em ClinicalTrials.gov. A informação que temos disponível nesse estudo é o que está publicado (lá). "
Certo, nós entendemos - há coisas que você simplesmente não pode dizer. Mas para uma empresa que tirou o tapete de tantos leais clientes com o lapso na disponibilidade original do Navigator, esperamos um pouco mais. Pessoalmente, é difícil ver como alguém pode olhar além do comportamento passado pela Abbott e assinar com a empresa no futuro … mas, quem sabe. Tudo depende do dispositivo, aparentemente.
A partir de agora, Christensen diz que a Nav II está disponível na Bélgica, Dinamarca, França, Alemanha, Israel, Holanda, Noruega, Suécia e o Reino Unido. Então, teremos que esperar e ver se ele nos atinja para os Estados Unidos.Animas Vibe Integrated Pump & CGM System
Todos esperaram a próxima bomba integrada e CGM, e aquela que parece estar no horizonte no futuro próximo, Animas Vibe (que obteve a aprovação européia no verão de 2011). Com a aprovação emocionante do Dexcom G4 no ano passado Platinum CGM, a peça final para o Vibe parecia ter caído no lugar. Funcionários da empresa disseram que estavam esperando a aprovação do G4 para enviar o Vibe atualizado ao FDA para aprovação.
"
Traz o Animas Vibe para EUA e Canadá é uma das nossas maiores prioridades. Estamos empenhados em enviar o PMA (pedido de aprovação prévia ao mercado) para o Sistema de Gerenciamento de Glucose Animas Vibrante o mais rápido possível em 2013.
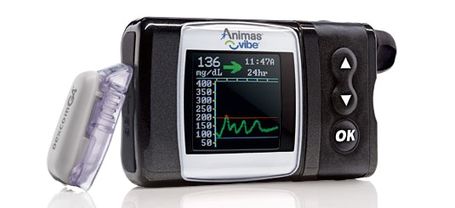
A empresa ainda tinha a dizer sobre um relógio diferente. Em dezembro, a Animas enviou uma carta aos clientes sobre um problema técnico com seus modelos anteriores de bomba de insulina 2020 (os antes do Ping). Basicamente, o software nessas bombas tem uma falha que significa que a bomba 2020 não enviará mais insulina após a meia-noite em 31 de dezembro de 2015 (!)
Um "alarme de serviço de chamada" será materializado. Então, cerca de três anos antes de este problema se manifestar por uma bomba que foi recentemente descontinuada na U. S. e no Canadá, a Animas está alertando todos, com a nota de que o rótulo do produto será atualizado para refletir esta questão. Nada afetará as operações da bomba antes de 2016, então as bombas não precisam fazer nada agora, e as garantias de substituição para uma bomba livre antes estão sendo honradas.
Muito ruim, o mesmo tipo de comunicação pró-ativa não está sendo aplicado ao Animas Vibe e ao arquivamento da papelada, que está "provavelmente" acontecendo no primeiro semestre deste ano, nos dizem.
Asante Pearl Pump
Pouco aconteceu com a Asante Solutions, com base em Sunnyvale, Califórnia, uma vez que recebeu a aprovação da FDA para uma nova bomba de insulina parcialmente descartável em maio de 2011. O Asante Pearl deveria estar bem no mercado até agora , mas isso não veio a ser. Nós vimos a Asante em uma apresentação durante as Sessões Científicas da ADA em junho, e eles também estão contratando novos executivos ao longo de 2012.Mas não houve muito mais deles …
Quando questionado, o porta-voz da empresa, Steve Bubrick, nos diz que a Asante espera que a Bomba de pérolas seja lançada em pequena escala em meados de 2013, tomando uma abordagem regional e não nacional "obtenha a receita corretamente". Eles estão construindo inventário e se preparando para o lançamento iminente, ele diz.

Sensível porque você não precisa preencher um reservatório como com bombas tradicionais. Em vez disso, ele usa um cartucho pré-cheio de 300 unidades que se encaixa em um slot de disposição na parte de trás da bomba (o filme preto retratado). Esta porção anexa e se destaca no "cérebro" não descartável da bomba (controlador com botões e tela) que parece semelhante a muitos outros lá fora. A cada sete dias, separe a porção do cartucho e jogue-o antes de conectar um novo. A bomba usa um conjunto de infusão proprietário com tecnologia de oclusão embutida que, como qualquer outro conjunto no mercado, precisa ser trocada a cada 2 ou 3 dias. A partir de agora, a Pearl apenas tira um cartucho Humalog - mas Bubrick diz que espera expandir para outras insulinas como o Novolog no futuro próximo.
OmniPod Next-Gen do Insulet
É difícil perder
as notícias de meados de dezembro sobre o próximo OmniPod que obteve a aprovação da FDA. Menor, mais elegante, mais fino. Mas com esse obstáculo limpo, quanto tempo demorará para que os últimos Pods possam sair para PWDs? O Insulet vem atualizando seu site regularmente e, a partir de agora, a linha do tempo parece ser final de fevereiro ou até o final de março. Mas algumas pessoas estiveram ouvindo outras datas, como alguns pais da criança com Diabetes D, que dizem nos fóruns que lhes disseram que a mais nova bomba não estará disponível até abril.

Sistema de bomba de insulina Medtronic 530G (com Sensor Enlite)
Em junho de 2012, a Medtronic enviou seu próximo sistema CG-bomba-CGM para a FDA para avaliação.O que se conhece como a bomba Medtronic Veo na Europa (disponível lá desde 2009!), Esta bomba possui o recurso de suspensão de baixa glicose (LGS) que usa CGM-tech para detectar a baixa quantidade de açúcar no sangue de uma pessoa e suspende automaticamente a entrega de insulina por até dois horas, se não respondem aos alarmes. Este é o próximo passo em direção ao Pâncreas Artificial, e nossa comunidade antecipou ansiosamente a chegada da bomba mais inteligente a U. S.
Essa nova bomba incluirá o esperado sensor CGM de próxima geração chamado Enlite (disponível no exterior desde 2011). Aqueles de nós que utilizamos o sensor Medtronic CGM atual referem-se a ele como "o arpão", pois usa uma agulha longa que pode ser um pouco dolorosa na injeção e, em seguida, flop e puxa um pouco durante o desgaste. Então, estamos aturdidos com este novo sensor de Enlite
que é supostamente menos doloroso, mais preciso e tem um tempo de uso de seis dias em vez de três.

Muitos especulações on-line especulam que o FDA não aprovará um sem o outro, especificamente porque o sensor Enlite projetado para uma vida mais longa não funcionará com as bombas de insulina atuais. Em vez disso, o Enlite precisaria que a bomba 530G fosse aprovada. Word em fóruns de CWD e em escritórios de médicos em todos os lugares é que isso está "em breve". Como no início de 2013, todos esperamos …
Ainda assim, isso poderia significar qualquer coisa.
Uma recente promoção de fim de ano da Medtronic ajudou a alimentar essa mensagem. Dito a "Garantia de Nova Tecnologia", este programa encorajou as pessoas a comprar a mais recente bomba de insulina Paradigm Revel (523 ou 723) entre 15 de novembro e 31 de dezembro de 2012, com garantia de atualização gratuita para o sistema de bomba mais recente antes de abril 13, 2013. O problema com isso? Bem, a partir de agora, o Revel IS é o modelo de bomba mais recente e atual - então você compraria o modelo mais novo com o que é basicamente uma falsa garantia de atualização. A MENOS QUE o 530G seja aprovado antes de abril e a Medtronic disponibilizou-o para preencher essa garantia.
Hmmm … talvez Medtronic saiba algo que ainda não nos disseram. Então, nós perguntamos.Infelizmente, como o resto das empresas do dispositivo D, a Medtronic não está dizendo muito oficialmente que significa qualquer coisa
.

Executamos uma variedade de promoções ao longo do ano … Executamos esta promoção de fim de ano para ajudar os pacientes a tirar proveito das franquias de final de ano ou adicionais os fundos dentro da sua conta de poupança de saúde, sem medo de perder qualquer nova tecnologia (dado que as nossas bombas têm garantia de 4 anos). Em relação ao período de tempo, cada promoção que temos tem que ter uma data de início e término. Nós escolhemos o início data do final do ano pelo motivo acima indicado. As informações relativas ao número de clientes que participam da promoção são confidenciais. "
Então , como os outros dispositivos D, apenas o tempo dirá se / quando a Medtronic receber aprovação em 2013.
, o produto está pronto para a produção aqui nos EUA. Na Roche Diabetes Social Media Summit em Em agosto, aprendemos que, apesar da aprovação pela FDA da bomba inicial da Solo, a Roche não estava planejando vender comercialmente o dispositivo inicial porque não tinha um monitor integrado de açúcar no sangue ou integração CGM. Parece que eles sentiram que não seria capaz de competir contra bombas de patch existentes (OmniPod!) Sem esses recursos.

Também apresentamos consultas sobre o CellNovo Patch Pump e o adaptador de medidor de glicose / smartphone Dario, mas nenhuma das empresas respondeu. Em qualquer caso, ambos estão apenas tentando sair do terreno na Europa, então, basicamente, temos zero expectativa de vê-los como Estados Unidos em 2013.
Mais uma vez, ter uma idéia do que poderia estar no horizonte aqui nos EUA, teremos que ficar no mercado europeu neste ano.
Espero que veremos uma rápida reviravolta na aprovação regulamentar e alguns desses dispositivos D estarão prontos para o uso de U. S. PWD em pouco tempo! Afinal, são nossos relógios (saudáveis) que estão passando mais alto.
Disclaimer
: Conteúdo criado pela equipe da Diabetes Mine. Para mais detalhes clique aqui.
Disclaimer Este conteúdo é criado para Diabetes Mine, um blog de saúde do consumidor focado na comunidade de diabetes. O conteúdo não é revisado por médicos e não adere às diretrizes editoriais da Healthline. Para mais informações sobre a parceria da Healthline com Diabetes Mine, clique aqui.Comentários novos em nossa 'Cozinha de teste' para produtos de diabetes!

Os melhores produtos orgânicos para produtos químicos para pele com acne

Podem parecer a melhor rota para pele propensa à acne, mas não é a sua única opção. Combate zits e danos à pele com produtos naturais totalmente orgânicos.
O toque do relógio em novos produtos D para 2013



